


IDENTIFICACIÓN DE AISLAMIENTOS PROMISORIOS DE Trichoderma spp. PARA EL CONTROL DE Phytophthora cactorum (LEBERT & COHN) SCHRbETER, CAUSANTE DE LA PUDRICIÓN DE LA CORONA y RAíz DEL MANZANO (Malus domestica Borkh.) EN CALDAS.
Bernardo Villegas E MSc y Jairo Castaño Z PhDINTRODUCCIÓN
El agente de control biológico más estudiado y evaluado corresponde a especies de Trichoderma debido a su ubicuidad, facilidad de aislamiento y cultivo, rápido crecimiento en muchos sustratos, control de amplio rango de patógenos, acción como micoparásito y alta competencia por alimento y espacio (Wells, 1988) Elad et af (1983), mediante la técnica de cultivos duales (patógeno:antagonista) de Trichoderma harzianum o T. hamatum con Rhizoctonia solani o Sclerotium rolfsii, encontraron micoparasitismo, indicando además el crecimiento del antagonista directamente hacia el patógeno Chambers y Scott \1995), utilizando la misma técnica, encontraron que T hamatum y T pseudokoningii inhibieron el crecimiento de Phytophthora spp., aparentemente por antagonismo directo con menor' inhibición por antibiosis. Esta misma técnica fue utilizada por Smith et af (1990), para determinar la actividad de Trichoderma spp contra P cactorum en manzano
La investigación de especies de Trichoderma como agentes de control biológico de enfermedades radiculares en plantas leñosas causadas por Phytophthora spp es muy limitado, especialmente en manzano (Roiger y Jeffers, 1991 )
Por estas razones se plantearon como objetivos de este trabajo (a) La obtención de aislamientos promisorios de Trichoderma spp. para el control de P. cactorum, agente causal de la Pudrición de cuello y raíz del manzano, (b) Evaluar en condiciones in vitro la capacidad antagónica de aislamientos de Trichoderma spp. contra P cactorum y (c) Identificar el ó los aislamientos de Trichoderma spp. más promisorios para el control de P cactorum
MATERIALES y MÉTODOS.
El aislamiento de P cactorum usado en este estudio, se obtuvo en la finca "Floridablanca", del municipio de Villamaría (Caldas), de muestras de corteza enferma y de suelo alrededor de árboles de manzana Anna sobre patrón MM106 de 8 años de edad, usando los métodos descritos por Villegas (1999).
Recolección de muestras y aislamiento de Trichoderma spp. En 50 fincas sembradas con manzano en siete municipios del departamento de Caldas, se identificaron árboles con sintomas de Pudrición de cuello y raíz. En cada finca, se tomaron muestras de súelo en los primeros 5 cm adyacentes a la corona del árbol, hasta obtener una muestra homogénea de 300-400g de suelo Adicionalmente, en el mismo sitio se cortaron fragmentos de raíces de 2-3 m m de diámetro
Para el aislamiento de Trichoderma spp del suelo, se tomaron de tres a cuatro terrones de aproximadamente 5-7 m m de diámetro los cuales se colocaron equidistantes en una caja de Petri con 10 m I de papa-dextrosa-agar (PDA Oxoid; 39g.L-1) previamente esterilizados a 20 psi y 121 5°C durante 20 min en un autoclave electrónico Sterilof serie 91 (Lofar Ltda.); luego se incubó durante 5 a 7 días a temperatura ambiente (20-22°C) al cabo de los cuales -cuando aparecieron masas algondonosas de color verde oliva correspondientes a las conidias del hongo se tomaron dos porciones de dicha masa y bajo condiciones asépticas se sembraron en el centro de dos cajas de Petri con PDA. En caso de contaminación con bacterias o ácaros, se tomó una porción superficial de la masa de esporas y se sembró en PDA, repitiendo el proceso hasta lograr la pureza del hongo.
Para el aislamiento de Trichoderma spp. de raíces, y bajo las mismas condiciones del procedimiento anterior, se tomaron muestras de éstas y se lavaron con agua corriente, luego se cortaron en trozos de aproximadamente 7 a 10 m m de longitud y se colocaron cuatro trozos equidistantes en una caja de Petri con PDA Ocho días después, al observar las masas de conidias típicas del hongo, se tomaron porciones de conidias de aproximadamente 1-2 m m de diámetro y se sembraron en PDA, de igual forma a la descrita anteriormente Evaluación del antagonismo entre Trichoderma spp. y P. cactorum. De dos cajas de Petri con harina-maiz-agar (HMA) y con cultivos puros de P. cactorum de 5 días de edad y en crecimiento activo, se cortaron varios discos del borde de la colonia con un sacabocado de 4 m m de diámetro Los discos se colocaron individualmente en cajas de petri con PDA, a 2.5 cm del centro de la caja y con el hongo directamente en contacto con el medio Se dejaron en incubación a temperatura ambiente y fotoperíodo normal durante 48 horas, al cabo de las cuales, en frente de cada uno y separadó 5 cm, se colocó, de igual forma, un disco de PDA de tamaño similar con micelio de un aislamiento de Trichoderma spp. de 3 días de edad Se dejaron en incubación por 3 días a temperatura ambiente y fotoperíodo normal y se hicieron lecturas del radio de ambas colonias a las 24 y 48 horas El tratamiento testigo consístió de un disco de PDA frente a cada aislamiento de Trichoderma spp. Cada experimento se realizó simultáneamente para todos los aislamientos de Trichoderma spp. obtenidos de cada municipio empleando un diseño completamente al azar (CM) con cuatro repeticiones
Para el cálculo de la tasa de crecimiento en mm-h-1 de ambos hongos, se utilizó la siguiente fórmula (Zadoks y Schein, 1979).

Mediante el programa estadístico SAS (Statistical Analysis System) se hicieron análisis descriptivos y de varianza; las tasas promedio de todos los aislamientos se compararon mediante la prueba de Duncan al 5%, con el fin de escoger, de cada municipio, de dos a cuatro aislamientos con las mayores tasas Este mismo procedimiento se aplicó para hallar la tasa de crecimiento promedio de P cactorum.
Los aislamientos seleccionados se evaluaron bajo las mismas condiciones y diseño similares al procedimiento anterior. Se hicieron evaluaciones del radio de crecimiento de ambos hongos cada 12 horas hasta que las colonias hicieron contacto. Luego se escogieron los cuatro aislamientos con mayores tasas de crecimiento De los cuatro aislamientos seleccionados de Trichoderma spp se escogieron dos contrastantes visualmente por coloración de masa de conidias y por tinción del medio de cultivo PDA, los cuales se enviaron al Instituto Internacional de Micologia (IMI) en el Reino Unido para la identificación de la especie
RESULTADOS y DISCUSIÓN.
Aislamiento de Trichoderma spp. De las 50 fincas muestreadas se obtuvieron 51 aislamientos de Trichoderma spp., utilizando el método de siembra directa de suelo sobre el medio de cultivo y 35 aislamientos por el método de siembra directa de raices Antagonismo in vitro. En el crecimiento de P. cactorum no se presentaron diferencias estadísticas significativas entre los aislamientos de cada municipio; sin embargo, se presentaron variaciones entre municipios, las cuales se debieron a que los experimentos se realizaron en diferentes épocas, variando la temperatura ambiental, la cual condicionó el crecimiento de los aislamientos. Adicionalmente se hizo una comparación general entre todo$ las aislamientos obtenidos de raíces con los provenientes de suelo, y se estableció que presentaron mayor tasa de crecimiento los primeros diferenclándose estadísticamente de los segundos en 002 mmh-1
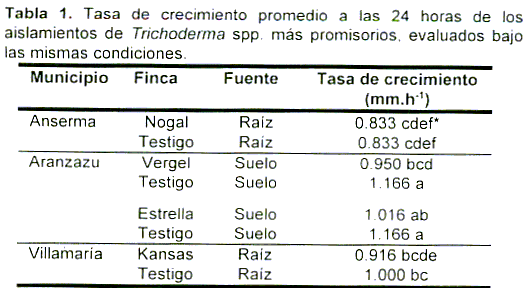
En total se escogieron 19 aislamientos promisorios que se evaluaron simultáneamente; el análisis de varianza y la prueba de comparación de Duncan, mostraron diferencias significativas entre ellos El mejor aislamiento, procedente de la muestra de suelo de la finca 'Estrella', no presentó diferencias estadísticas con el procedente del suelo de la finca 'Vergel' (Tabla 1 ), debido probablemente a que correspondan a la misma especie, ya que sus características de crecimiento, esporulación y tinción del medio de cultivo PDA de color verde limón fueron similares; aunque sí presentaron diferencias significativas con los aislamientos de raíces procedentes de las fincas 'Nogal' y 'Kansas' (Tabla 1 )
Aunque el primer trabajo de antagonismo in vitro de Trichoderma spp contra P cactorum realizado por Smith et a{ (1990), no permitió seleccionar un biocontrol promisorio a través de cultivo dual sobre medio HMA, debido probablemente a la inmersión del patógeno en el medio, el resultado de este estudio sí permitló una diferenciación clara de los aislamientos más promisorios en PDA.
Además de la rapidez que deben manifestar para parasitar o competir con P cactorum, algo corroborado en medios de cultivo distintos al PDA, Finlay y McCracken (1991) observaron micoparasitismo in vitro de hifas de T harzianum sobre hifas de Phytophthora cinnamomi, mientras que Bell et a{ (1982), observaron antagonismo de T harzianum con Phytophthora nicotianae, encontrando que 30 de los 32 aislamientos evaluados crecieron sobre el patógeno y cubrieron toda la superficíe del medio; similar a lo encontrado en este trabajo donde el 100% de los aislamientos cubrieron el medio en 72 horas.
De acuerdo con el Instituto Internacional de Micología (IMI) los aislamientos provenientes de Estrella-suelo y Kansas-raíz" fueron identificados como Trichoderma pseudokoningii Rifaí.
Los resultados de este estudio permítieron concluir que no hubo estímulo de P cactorum hacía Trichoderma spp., que según su procedencia, la misma especie de Trichoderma puede producir colonias diferentes en esporulación, color y tinción del medio de cultivo y que los aislamientos de Trichoderma spp. con las mejores características de competencia y micoparasitismo fueron los pertenecientes al municipio de Aranzazu. El presente estudio constituye el primer reporte de T pseudokoningii como excelente controlador biológíco in vitro de P. cactorum.
BIBLIOGRAFIA.
BELL, DK, WELLS, H.D and MARKHAM, C.R 1982 In vitro antagonism of Trichoderma species against s ix fungal plant pathogens Phytopathology, 72. 379-382
CHAMBERS, SM and SCOTT, ES 1995 In vitro antagonism of Phytophthora cinnamomi and P citricola by isolates of Trichoderma spp and Gliocladium virens Journal of Phytopathology, 143.471477
ELAD, Y., CHET, I, BOYLE, P., and HENIS, Y 1983. Parasitism of Trichoderma spp. on Rhizoctonia solani and Sclerotium rolfsiiScanning electron microscopy and fluorescence microscopy. Phytopathology, 73.85-88.
FINLAY, AR and McCRACKEN, A.R 1991 Microbial suppression of Phytophthora cinnamomf Pages 383-398 In. Phytophthora JA Lucas, RC Shattock, DS Shaw and L.R. Cooke, eds Cambridge Univ Press, Cambridge, U K 447 p
ROIGER, DJ and JEFFERS, SN 1991 Evaluation of Trichoderma spp, for biological control of Phytophthora crown and root rot of apple seedlings Phytopathology, 81 910-917
SMITH, VL, WILCOX, WF. and HARMAN, G.E 1990 Potential for biological control of Phytophthora root and crown rots of apple by Trichoderma and Gliocladium spp Phytopathology,80.880-885
VILLEGAS, EB 1999 Identificación de aislamientos promisorios de Trichoderma spp para el control de Phytophthora cactorum (Leb. & Cohn) Schroeter, causante de la Pudrición de la corona y raíz del manzano (Malus domestica Borkh.) Tesis Maestría en Fitopatología Universidad de Caldas, Manizales, Caldas, Colombia 100p
WELLS, H.D 1988 Trichoderma as a biocontrol agent Pags 71-82 In Biocontrol of Plant Díseases Vol I. KG. Mukerji and KL Garg, Eds CRC Press, Boca Ratón, FL 211 pp
ZADOKS JC and SCHEIN, RD 1979 Epidemiology and plant disease management Oxford University Press USA 427p
![]()