


Propagación in vitro de orquídeas a partir de semilla sexual
Leticia Serna Angel. M.Sc.INTRODUCCIÓN
Bajo condiciones naturales, las semillas de Orquídeas son liberadas de sus cápsulas cuando estas maduran y son llevadas por el viento, pudiendo germinar y crecer si eventualmente caen en un medio adeclJado para la germinación. Sin embargo, dichas semillas tienen pocas posibilidades de sobrevivir, debido a que muchas de las especies de orquídeas sólo son capaces de crecer en presencia de un hongo simbiótico: Rhizoctonia spp.
Las semillas de orquídeas pueden ser germinadas en troncos y raíces de árboles establecidos; sin embargo, el porcentaje de germinación es muy bajo. A pesar de que cada cápsufa puede contener aproximadamente tres millones y medio de semillas, sólo unas cuantas germinan, dificultando así la sefección y producción masiva para fines comerciales (Cañas, 1991 ). Por esta razón, varios investigadores han trabajado en la obtención de medios de cultivo que permitan un alto porcentaje de germinación. Knudspn (1.946) logró la germinación asimbiótica de orquídeas en medio de cultivo que contenía pulpa de banano, para contrarrestar las bajas concentraciones de nutrientes. El medio de cultivo desarrollado por Murashige y Skoog (1962), ha sido probado exitosamente para la germinación y crecimiento de muchas especies, debido principalmente a los altos contenidos de nitrógeno y potasio.
Las orquídeas crecen prácticamente en todas las latitudes; sin embargo, una gran mayoría es originaria de los trópicos. Colombia es uno de los centros de origen donde se siguen reportando especies nuevas, manteniendo el interés de los diferentes cultivadores por hacer más eficiente y rápido el proceso de germinación. A este repecto, Alarcón y Angarita (1.984) compararon la germinación simbiótica y asimbiótica de especies de orquídeas nativas en la Sabana de Bogotá, logrando establecer un procedimiento adecuado para la germinación.
Para los cultivadores de orquídeas es fundamental lograr un alto porcentaje de germinación que asegure la reproducción eficiente de sus híbridos, razón por la cual se llevó a cabo el presente experimento, con el fin de establecer un procedimiento simple que asegure un alto porcentaje de germinación en el menor tiempo posible.
MATERIALES y MÉTODOS
Cápsulas de los géneros Catleya y Cymbidium, fueron colectadas cuando estaban maduras, pero antes de que se presentara el fenómeno de la dehiscencia, y fueron llevadas al la'boratorio don fueron lavadas mediante inmersión en una solución de hipoclorito de sodio (blanqueador comercial) al 10%, durante 10 minutos, luego fueron lavadas dos veces con agua destilada estéril y sembradas en condjciones asépticas. Para ello, se cortó la cápsula en la parte superior y se permitió que las semillas cayeran libremente sobre el medio de cultivo.
Los medios evaluados se incluyen en la Tabla 1. La siembra se realizó aleatoriamente de tal manera que en cada medio se tuviera una muestra representativa de los diferentes estados de madurez de las semillas dentro de la cápsula.

Los medios fueron suplementados con 3% de sacarosa, solidificados con 0.7% de Bacto Agar (Difco), incubados a temperatura ambiente (20 25 °C) e iluminados directamente con tubos fluorescentes durante 8 horas diarias. Para la evaluación correspondiente se consideró como semilla germinada aquella que mostrará ápice de radícula al momento de la lectura.
RESULTADOS
Se sembraron 25 réplicas de cada medio de cultivo y se evaluó el porcentaje de germinación con respecto al tiempo expresado en semanas. Los resultados se presentan en la Tabla 2.
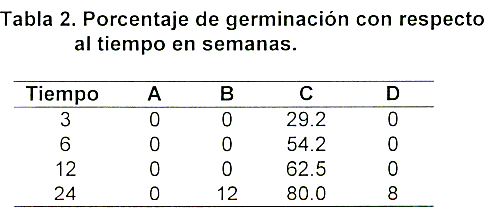
Las semillas se evaluaron semanalmente para descartar contaminación y evaluar el proceso de desarrollo. Durante los 6 meses de observación se presentó un 9% de contaminación. Se pudo observar que el suplemento de ANA y BAP en el medio C, permitió el mayor porcentaje de germinación en el menor tiempo. En el medio A no se presentó germinación en ras 24 semanas y las semillas continúan de color blanco. En el medio B sólo se presentó un 12% de germinación a las 24 semanas y las semillas en los otros frascos se han tornado de color pardo, lo mismo que en el medio D. El porcentaje de germinación en estos tres medios ha sido bajo y lento. En el medio C el proceso de germinación se inició a las 3 semanas, observándose gran cantidad de protocormos de color verde, los cuales desarrollaron hoja y raíz inicial a las 6 semanas, presentándose gran proliferación de las mismas en cada frasco. Para evitar la competencia entre las plántulas y permitir el correcto desarrollo, a las 8 semanas se hizo una transferencia a nuevo medio de cultivo, permitiendo el contacto directo con el medio y por lo tanto el libre crecimiento.
Se evaluaron los cuatro medios de cultivo para determinar cuál de ellos permitía el mejor desarrollo; los resultados fueron muy semejantes a los encontrados en la germinación: El medio C permitió rápido crecimiento de hoja y desarrolló raíces nuevas, doblando el tamaño de las plántulas en 4 semanas. En los medios A y B las plántulas han crecido lentamente pero se han mantenido vivas, mientras que en el medio D las plántulas se tornaron cafés y sólo el 20% de ellas permanecen vivas.
Se puede concluir que un medio de cultivo con las sales MS, suplementado con vitaminas, azúcar, ANA y BAP permite una rápida germinación de las semillas y un crecimiento saludable de las plantúlas, las cuales pueden ser adaptadas a condiciones de campo dado que en este medio desarrollan bien la raíz y las hojas, haciendo más fácil su adaptación.
BIBLIOGRAFíA
ALARCON , C. y ANGARIT A, A. Estudio de los medios simbióticos y asimbióticos para la propagación sexual de orquídeas nativas de la Sabana de Bogotá. Prímer congreso Nacíonal de Cultivo de Tejídos Vegetales. 1984.
CAÑAS, B. M., Cultivo asimbiótico. In Vitro en Orchidaceae. Rev UIS. 20(1): 35-44.1991.
KNUDSON, L. A new nutrient solution for germination of orchid seed. Amer. orchid. Soc. 15: 214 217.1946.
MURASHIGE, T. y SKOOG, F. A revised medíum for rapid growth bioassays with tobacco tissue cultures. Physiol. Plant, 15: 473 497.1962.
![]()